|
DETERMINACIÓN GENÉTICA DEL SEXO EN TORTUGAS: TSD Y GSD
Txema López, 2006
La determinación del sexo por
temperatura (TSD, por sus siglas en inglés) es un fenómeno bastante común tanto en vertebrados como en
invertebrados. Sin embargo, es en los reptiles donde más se ha
estudiado y por tanto, de donde más información interesante y
conclusiones podemos sacar. En este artículo veremos por qué a ciertos
seres vivos les puede interesar, o no, dejar a las circunstancias
climatológicas influir en algo tan importante para la supervivencia de
su especie, como es el ratio machos/hembras.
GSD: determinación genética del sexo.
Todas las especies animales y vegetales tienen un número de cromosomas
constante y determinado, que constituyen su cariotipo: la
forma, cantidad y tamaño de los cromosomas. Aunque la diferencia entre
un individuo y otro es la información especificada en los genes de
estos cromosomas.
En muchos organismos, uno de los pares de los cromosomas homólogos es
distinto al resto, realizando la determinación genética del individuo.
A estos cromosomas se les llama cromosomas sexuales o
heterocromosomas, porque determina el sexo por la proporción de
los dos cromosomas homólogos.
• Sistema de determinación XY: es propio del hombre y muchos
otros animales. Las hembras, siendo XX, darán
gametos
iguales con cromosoma X, sexo homogamético y los machos,
siendo XY, darán dos tipos de gametos, uno con el cromosoma
X y otro con el cromosoma Y. La probabilidad de que en la
fecundación, al unirse los gametos, resulte una combinación XX
(hembra) o XY (macho) es del 50%.
• Sistema de determinación ZW: en otras especies (mariposas,
p.ej.) ocurre lo contrario, el sexo masculino es homogamético (ZZ) y el
femenino heterogamético (ZW).
• Sistema de determinación XO: otras especies (peces, insectos,
anfibios) que no tienen el cromosoma Y, determinándose el sexo por el
número de cromosomas X, macho XO y hembra XX.
• Sistema H: cromosomas sexuales homomórficos, existen
cromosomas sexuales, pero no son de diferente naturaleza.
No obstante, en otros muchos organismos, estos cromosomas sexuales
diferenciados, no existen. La mayoría de tortugas y cocodrílidos
presentan cariotipos que muestran esta ausencia, mientras que, sin
salir de la familia de los reptiles, serpientes y lagartos si
presentan estos cromosomas.
Para el sistema XY, en la meiosis femenina, cada óvulo recibe un
cromosoma X. En la meiosis masculina, cada espermatozoide puede
recibir un cromosoma X o un cromosoma Y. Si un espermatozoide que
lleva un cromosoma X fecunda al óvulo, el cigoto dará lugar a una
hembra (XX); si un espermatozoide que lleva un cromosoma Y fecunda al
óvulo, el cigoto dará lugar a un macho (XY). No obstante, esto no es
lo habitual en las tortugas, aunque sí lo que todos conocemos porque
es aplicable a los humanos y a todos los mamíferos. La probabilidad
genética siguiendo las leyes de distribución mendeliana de obtener
machos o hembras es de un 50%.
En tortugas, tan solo Acantochelys (Chelidae),
Staurotypus (Staurotypidae), y Siebenrockiella (Bataguridae),
siguen este patrón XY (Janzen y Paukstits, 1991a). Un estudio reciente
también coloca en este grupo a Chelodina longicollis (Ezaz y
Valenzuela, 2006), por la presencia de un par de microcromosomas XY.
Es posible que otras especies con GSD también los posean y no hayan
sido detectados. Otras tortugas con GSD que siguen otros sistemas
citados son Emydura y Chelodina (Chelydae) (Janzen
y Paukstits, 1991ª), Apalone (Janzen y Paukstits, 1991ª) y
Pelodiscus (Choo y Chou, 1992) (Trionichydae), Claudius
(Staurotypidae) (Vogt y Flores Vilella, 1992), Calemys (Janzen
y Paukstits, 1991ª ) (Emydinae), regidos por el sistema H y
Kachuga (Bataguridae) (Janzen y Paukstits, 1991ª), regido
por el sistema ZW.

Kachuga smithii (Marcelo
López).
La determinación del sexo en los vertebrados está regida por una serie
de mecanismos genéticos y ambientales. Los taxones más estudiados, los
pájaros y los mamíferos, responden a los sistemas XX/XY y ZZ/ZW
mencionados con anterioridad. Los reptiles muestran una diversidad
mucho mayor, mostrando la determinación genética del sexo (GSD) con
ambos sistemas XY y ZW (con y sin cromosomas heteromórficos) y la
determinación del sexo por temperatura (TSD). La detección del
sexo heterogamético es realmente muy difícil en especies que no
presentan cromosomas sexuales diferenciados, como ocurre con muchas
especies de anfibios, peces, e incluso algunas de lagartos y
serpientes, además de casi todas las especies de tortugas. Los
cromosomas sexuales heteromórficos son muy raros en ellas. De las 254
especies conocidas de tortugas, solamente 155 están cariotipadas, lo
cual representa sólo un 61% del total. De estas, sólo 4 presentan
macrocromosomas heteromórficos (siendo el estudio realizado para
Acantochelys radiolata bastante discutible, puesto que sólo se realizo
para un macho) y una, microcromosomas, la Chelodina longicollis. (Ezaz
y Valenzuela, 2006). La diferenciación de los cromosomas sexuales
parece seguir la regla de que el miembro heterogamético del par se
degenera (Charlesworth, 1996). Un aspecto interesante de los
cromosomas sexuales de las tortugas, es que, a diferencia de otros
vertebrados, el cromosoma Y no es siempre el cromosoma sexual más
diferenciado (Olmo, 1986). Por ejemplo en Staurotypus, el cromosoma X
sufre diferenciación a partir del par del parental, mientras que el Y
parece no sufrir modificación alguna (Sites et al. 1979).

Starotypus salvinii
(Marcelo López).
El caso de la Chelodina longicollis es particularmente excepcional en
el mundo de las tortugas, por lo que un comentario más extenso del
estudio de Ezaz y Valenzuela resulta de particular interés. La
incubación de huevos de esta especie en un rango tanto constante como
fluctuante demostró que esta especie australiana muestra determinación
genética del sexo. Un estudio de cariotipación realizado por Bull y
Legler (Bull y Legler, 1978) no encontró cromosomas sexuales
heteromórficos, lo cual la englobaba en el sistema H del que
hablábamos al principio. No obstante, el uso de técnicas modernas,
como la hibridación comparativa genómica (CGH) ha revelado la
existencia de cromosomas crípticos en diversas especies de reptiles
con un supuesto sistema H.
Un estudio reciente realizado para el lagarto australiano Pogona
vitticeps (Viets et al, 1994, Harlow 2001), demuestra que el anterior
estudio de cariotipación que colocaba a esta especie en el sistema H (Witten
1983) no es correcto. Ezaz et al. (Ezaz et al. 2005) han desvelado la
existencia de cromosomas sexuales crípticos en esta especie, de
difícil descubrimiento. Son crípticos en el sentido de que no son
visibles por medio de las técnicas microscópicas tradicionales, sino
que necesitan hacer uso de la mencionada CGH. Este estudio ha
descubierto que las hembras de Pogona son heterogámicas (sistema ZW).

Chelodina sp. (Marcelo
López).
El cariotipo de Chelodina longicollis es 2n=54, con 12 pares
designados como macrocromosomas y 15 como microcromosomas. La
diferencia entre los cromosomas X e Y es bastante sutil, lo cual
demuestra que se encuentran en un estadio de diferenciación muy
primitivo, y que no ha transcurrido un tiempo suficiente para la que
los cromosomas protosexuales hayan sufrido una diferenciación a gran
escala. Esto nos lleva a la conclusión, que
luego analizaremos con más profundidad, de que la TSD es el mecanismo
de diferenciación sexual ancestral en las tortugas, mientras que la
GSD es una evolución más reciente, además de que la GSD ha
evolucionado varias veces en las tortugas de manera independiente, y
al menos en 5 ocasiones, (Janzen & Krtez, 2004), dado lo primitivo de
la diferenciación en Chelodina longicollis. No obstante, el sistema
homomórfico H parece ser también estable, dado el uso antiquísimo que
hacen de el algunas serpientes y anfibios. En cualquier caso, es
posible que el estudio del cariotipo de otras especies supuestamente
poseedoras de cromosomas sexuales homomórficos nos de un resultado
similar.
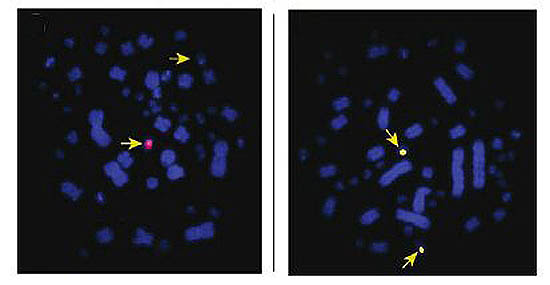
(Cromosomas de Chelodina longicollis, izquierda macho,
derecha hembra. Las flechas marcan los cromosomas X e Y). Foto:
Ezaz, T., Valenzuela, N. “An XX/XY sex microchromosome system in a
freshwater turtle, Chelodina longicollis (Testudines: Chelidae) with
genetic sex determination”. Chromosome Research (2006) 14:139-150.
El hecho de que la GSD sea una evolución reciente implica que la
diferencia entre TSD y GSD no es tan profunda como parece. En un único
género como Clemmys, la tortuga moteada (Clemmys guttata) pertenece al
grupo TSD mientras que la tortuga de madera (Clemmys insculpta)
pertenece al grupo GSD. LA cosa se puede complicar mucho más. Aunque
lo describiremos posteriormente, hay varios patrones TSD (Ia y II se
dan en tortugas), y en un mismo género (Kinosternidae), se pueden dar
los dos patrones TSD y el GSD. Kinosternon integrum pertenece a TSD Ia,
por ejemplo, Sternotherus minor a TSD II, y Kinosternon bauri se rige
por GSD y TSD. En el caso de la tortuga aligator (Macrochelys
temminckii) parece incluso que no hay una temperatura a la que se
desarrollen machos para todos los huevos de una puesta. Este fenómeno
sugiere la posibilidad de que siempre, al menos un tercio de los
huevos están destinados a ser hembras independientemente de la
temperatura.

© 2003 James H. Harding
Hibrido de Clemmys insculpta (GSD) x Emydoidea blandingii(TSD).
En cualquier caso, la ausencia de cromosomas heteromórficos no implica
necesariamente que la especie use TSD. De hecho, como comentábamos
antes, hay TSDs mal asignadas por el mero hecho de confundir
diferenciación y determinación sexual. Circunstancias como la
mortalidad embrionaria diferencial y reabsorción, y la reversión de
sexo inducida por temperatura pueden confundirse con TSD. Aunque no
abundaremos en estos mecanismos. (Valenzuela et Al. 2003). Para saber
si estamos ante TSD o GSD, podemos seguir el protocolo del gráfico I.
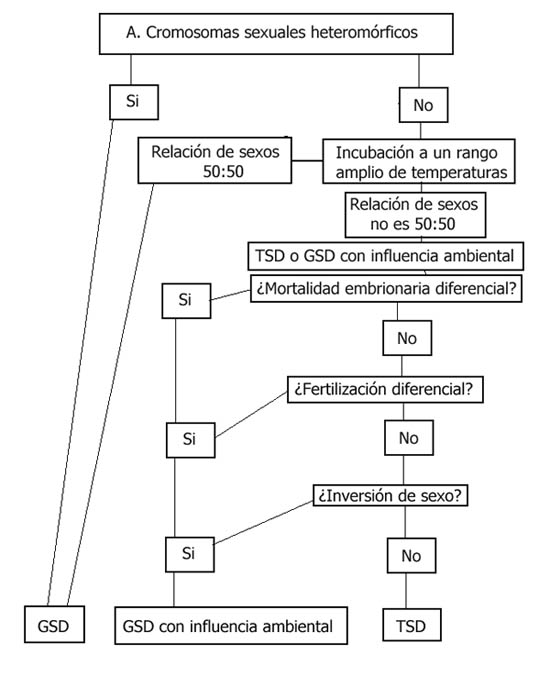
Gráfico 1. Protocolo de Identificación de GSD-TSD, adaptado de
Valenzuela, Nicole, Dean C. Adams, and Frederic J. Janzen. “Pattern
Does Not Equal Process: Exactly When is Sex Environmentally Determined?”
The American Naturalist 161.4 (2003).
Gráfico adaptado de
TSD Basics,
Temperature-Dependent Sex Determination in Turtles.
TSD: determinación del sexo por temperatura.
A mediados de los años 60 se realizó un descubrimiento realmente
curioso. Para una amplia variedad de reptiles, la temperatura de
incubación no sólo influía en el ratio de desarrollo embrionario, sino
que además determinaba su sexo. Esto es lo que se ha llamado
“Determinación del Sexo por Temperatura” más conocido por sus siglas
en inglés, TSD.
No todos los reptiles se rigen por el mismo patrón. Existen 3 patrones
de TSD perfectamente estudiados:
Patrón Ia : Lo muestran los podocnémidos, las tortugas marinas, la
mayoría de los emídidos, las tortugas terrestres y algunos batagúridos.
Si la temperatura del huevo permanece por debajo de cierta temperatura
durante un periodo determinado de tiempo, en el que el embrión está
desarrollando sus órganos sexuales, la futura tortuga será macho. Por
encima de esta “Temperatura pivotal”, será hembra. Los huevos
incubados en un rango cercano a esta temperatura pivotal darán lugar a
una mezcla de machos y hembras, e incluso puede ser que individuos que
presenten características de ambos sexos, aunque esta última
posibilidad es muy extraña. Este patrón solo se da en tortugas.
Patrón Ib: Típico de algunos cocodrílidos, los huevos incubados a una
temperatura superior a la pivotal dan lugar a machos. Ninguna tortuga
presenta esta variedad de TSD.
Patrón II: Lo muestran las tortugas mordedoras (Chelydra) ,
pelomedúsidos, algunos kinostérnidos y el batagúrido Melanochelys
trijuga. También lo presentan algunos lagartos y cocodrílidos. En este
tipo de TSD hay dos temperaturas pivotales. Las hembras se producen
por debajo de la primera y por encima de la segunda, es decir, sólo se
producen machos en un intervalo determinado de temperatura. Sin
embargo, a todos los efectos, equivale a usar el patrón Ia, puesto que
es muy extraño que las hembras pongan huevos donde se den las
condiciones para obtener hembras de baja temperatura.
Tabla 1.
|
Mecanismo de determinación sexual |
Especies de tortugas (Familia,
genero, o especie) |
|
TSD- Patrón I |
Bataguridae (algunas) Carettochelyidae, Cheloniidae,
Dermocheylidae, Emydidae, Testudinidae |
|
TSD- Patrón II |
Pelomedusidae, Kinosternidae, Macroclemys temminckii,
Bataguridae (algunas) |
|
GSD |
Platemys, Staurotypus, Siebenrockiella, Kachuga smithii, Chelidae |
Tabla
Adaptada de
Temperature-Dependent Sex Determination in Turtles.
En cualquier caso, la TSD se puede englobar en un fenómeno más global,
la ESD, la determinación ambiental del sexo. En algunas tortugas, no
sólo la temperatura determina el sexo, sino que la humedad también
influye. Se han realizado experimentos en los cuales, manteniendo a la
misma temperatura inferior a la pivotal unos huevos de Chrisemys picta,
pero con diferente nivel de humedad, los huevos incubados con humedad
alta han dado lugar sólo a machos, como cabía esperar, y los que han
soportado condiciones más secas, un número elevado e inesperado de
hembras.
La temperatura pivotal de las especies del patrón Ia varía de especie
a especie. Se dan valores desde los 27,5ºC de Chrisemys picta a los
32,5-34ºC de la Podocnemys expansa. La Gopherus polyphemus oscila entre
los 29 y 32ºC y la Testudo hermanni sobre los 31,5 ºC. Para la mayoría
de emídidos, la temperatura pivotal oscila entre los 28 y 30ºC.
En el caso de los animales que presentan patrón II, el límite inferior
está casi siempre por debajo de 27ºC. Se alcanza por debajo de los 22ºC
en poblaciones norteñas de Chelydra serpentina, pero pueden ser tan
altas como los 29ºC de la Pelomedusa subrufa. Los rangos superiores se
sitúan entre los 25,5ºC de la Kinosternon leucostomum y los 32,1 de la
Pelomedusa subrufa.

Chelydra serpentina (Aída
Rofríguez).
La temperatura pivotal parece tener una gran influencia sobre el lugar
que elige la tortuga para poner sus huevos. Por ese mismo
razonamiento, es lógico pensar que las tortugas han evolucionado para
tener una temperatura pivotal acorde a los lugares disponibles para
hacer las puestas. La Podocnemys expansa, que tiene la mayor
temperatura pivotal conocida, elige lugares situados en los bancos de
arena de los ríos, donde la temperatura puede ser realmente elevada.
Esto hace mayores las opciones de las crías de desarrollarse muy
rápido para poder escapar de las crecidas, que anegarían el nido, y no
cabe duda de que una temperatura pivotal tan alta se debe a esta
adaptación especial al medio.
Otro factor a tener en cuenta es la posición del huevo en el nido. Los
animales que se hayan desarrollado en la parte superior, y por tanto
más cálida, del nido, serán en su mayoría hembras. Los que hayan
nacido de un huevo incubado en la parte inferior, serán machos.
Se dan casos curiosos, como la influencia en la temperatura general de
los nidos por los propios huevos, lo que se ha dado en llamar
“calentamiento metabólico”. Es un fenómeno observado en nidos de
Chelonia Mydas , donde este calor es capaz de elevar la temperatura en
2,5 ºC y dar lugar a un 30% de hembras más. (Broderick, Godley, & Hays,
2001).
Otro fenómeno que se observa es que, en especies como Terrapene
carolina, que tienen un amplísimo rango de distribución, desde Canadá
a México, y por tanto medran en un intervalo de temperaturas extenso,
no se da un fenómeno de desviación del ratio sexual, cuando todo haría
pensar que en el sur deberían existir más hembras por el mero hecho de
hacer más calor. (Bull, Vogt, & McCoy, 1982). De hecho, estudios
realizados en poblaciones de Crysemys picta han demostrado que el
calentamiento que está sufriendo la tierra, de momento no ha provocado
cambios en los ratios sexuales de los nidos (Janzen 1994), pero hay un
peligro real de que esto no sea así para siempre. Una de las teorías
para explicar el fin de los dinosaurios es el rápido cambio climático
que se produjo en cierta época, y que los dinosaurios usaban TSD. (Standora
&Spotila, 1985).
No sabemos exactamente cómo trabaja la TSD. No tenemos una idea
real del proceso molecular que tiene lugar (Standora and Spotila,
1985). Sólo parece ser importante la temperatura a la que esté
sometido el huevo durante el primer sexto de la incubación. (Janzen,
1991).No tiene incluso por qué ser constante. Se debe mantener por
encima de la temperatura pivotal más de 4 horas como mínimo
para obtener hembras según estudios realizados. Además, se ha
demostrado que en la naturaleza suelen haber nidos que producen un
único tipo de crías, machos o hembras. Las hembras intentan que no se
produzcan mezclas de sexos en los nidos, sino se preocupan de buscar
lugares donde hacer nidos “de machos” y nidos “de hembras”.
Se han propuesto varios mecanismos para explicar el porqué de la TSD,
entre ellos la influencia del antígeno H-Y en las
gónadas, el cambio de sexo de machos a hembras (o a la inversa), por
acción de la
temperatura, y el control influenciado por temperatura de secuencias
de ADN determinantes del sexo. (Standora & Spotila, 1985). La
hipótesis del antígeno H-Y fue uno de los primeros mecanismos
propuestos para la TSD. Se creyó que el antígeno H-Y era determinante
de la diferenciación sexual, tras ser detectado en el sexo
heterogamético de un número de animales heterogaméticos, en su mayoría
homeotermos. Sin embargo, en estudios posteriores se encontraron
inconsistencias entre especies con TSD cuando eran probadas para TSD.
En cualquier caso, antígeno H-Y se ha revelado como el factor
determinante del sexo en los mamíferos (Janzen, 1991). Más
recientemente los investigadores se han centrado en el papel que
representan los esteroides en la diferenciación de las gónadas y
particularmente, los papeles de la aromatasa y los estrógenos (Pieau
et al, 1995).
La regulación por hormonas esteroides se han revelado como un
prometedor mecanismo para la TSD. La intervención de la aromatasa se
ha apuntado como un factor crítico en la conversión de andrógenos,
como la testosterona, en estrógenos (Janzen, 1991; Pieau et al, 1995).
Cuando se colocan estrógenos sobre la cáscara del huevo, o se inyectan
en él, en especies que presentan TSD, se da un proceso de feminización
en la mayoría de los casos, incluso a temperaturas productoras de
machos. (Janzen, 1991; Pieau et al, 1995). Por otro lado, la
aplicación de inhibidores de la aromatasa sobre huevos de Emys
orbicularis dio como resultado la masculinización de los embriones. El
nivel de estrógenos influye directamente en el proceso de
diferenciación de las gónadas en especies con TSD. Un elevado nivel se
relaciona con el desarrollo de los ovarios y un nivel bajo, con el de
los testículos. Parece ser que el papel de los andrógenos es más
discreto (Pieau et al, 1995). Para que este mecanismo sea correcto,
debe haber un mecanismo para la regulación termoselectiva de la
transcripción del gen de la aromatasa. El método más plausible es que
la temperatura afecte la transcripción del gen de la aromatasa a
través de otro factor como el AMP cícilico (Pieau et al, 1995).
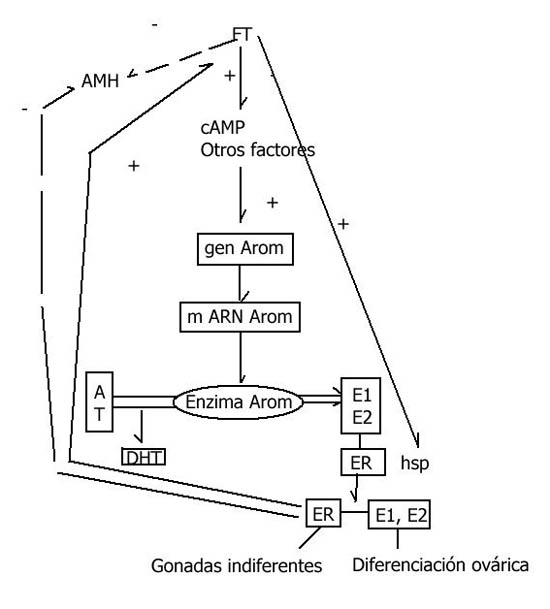
Gráfico 2. Posible mecanismo molecular para TSD a temperatura de
producción de hembras. Adaptada de Pieau, C., M. Girondot, G. Desvages,
M. Dorizzi, N. Richard-Mercier, and P. Zaborski.“Temperature Variation
and Sex Determination in Reptilia. Experimental Medecine 13 (1995):
516-523. Ecologie Systematique Evolution.
Gráfico adaptado de
Pieau et al, (1995) y Kyle Kinsell,
Mechanisms of TSD,
Temperature-Dependent Sex Determination in Turtles.
FT= Temperatura de producción de hembras
AMH= hormona anti-Mulleriana
A= androstenediona
E1= estrona
E2= estradiol-17B
ER= receptor de estrogeno
T= testosterona
DHT= dihydrotestosterona
hsp= proteína dependiente del calor
La TSD parece un modo de dejar a la naturaleza decidir los ratios
sexuales de las poblaciones de tortugas, pero hemos visto que existe
una elección evolutiva para no permitir que esto ocurra, la GSD de la
que antes hablábamos. Alguna ventaja debe tener la TSD para ser la más
generalizada. Sin embargo, la ciencia no es capaz de dar con esa
ventaja con exactitud. Sin embargo, se manejan varias hipótesis:
La temperatura no solo influye en el sexo del embrión, sino que
también lo hace en su crecimiento. Se sabe que el sexo que más rápido
crece también se hace más grande. Ewert y Nelson han certificado que,
en la mayoría de tortugas de patrón Ia, las hembras suelen ser más
grandes que los machos. Debe haber alguna clase de ventaja en que los
animales que tienen que ser más grandes en su edad adulta nazcan de
huevos incubados a una temperatura mayor. Una hembra cuanto más grande
sea, más huevos pondrá, asegurando así el futuro de la especie. Sin
embargo, esta explicación no es buena para Gopherus agassizii o para
Malacochersus tornieri. Los machos crecen con mayor rapidez, siendo
incubados a menor temperatura.

Malacochersus tornieri.
El crecimiento de los machos es más rápido que el de las hembras, pese
a ser incubado a menor temperatura (Antonio Alcalá-Zamora).
Otra explicación posible apunta a los ratios sexuales. Como antes
decíamos, con GSD los machos y las hembras deben aparecer más o menos
en el mismo número. Sin embrago, TSD tiende a producir más hembras. Un
macho puede fertilizar a muchas hembras, con lo que un número elevado
de éstos no es justificable. En el caso de la Pelomedusa subrufa, de
patrón II, el rango de temperaturas donde se producen machos es de tan
sólo 3,1 ºC.
Por otro lado, se argumenta que tortugas incubadas a diferentes
temperaturas tienen mayores posibilidades de sobrevivir a sus
depredadores. Un estudio llevado a cabo con neonatos de Chelydra
serpentina demostró que la descendencia obtenida a una temperatura
intermedia, la que produce mezcla de machos y hembras, tenía más
propensión a correr. Las crías incubadas a una temperatura muy
superior o inferior a la pivotal, tendían a quedarse quietas. Por
tanto, los neonatos incubados a una temperatura cercana a la pivotal
tenían mayores posibilidades de ser devorados antes de un año. (Janzen,
1995). Este estudio se ha realizado con una única especie y sería
interesante abundar ello.
Todo lo que aquí se expone demuestra lo poco que sabemos en realidad
sobre la TSD y no pretende más que exponer, al nivel de un simple
aficionado, lo que ocurre en realidad, y las implicaciones que tiene,
durante el proceso de incubación de los huevos de nuestras tortugas.
Tenemos que dejar a investigadores como Pieau, Janzen, Girondot,
Valenzuela y otros como ellos que den con los mecanismos y las razones
del por qué de la TSD.
BIBLIOGRAFÍA
Broderick, Annette
C., Brendan J. Godley, and Graeme C. Hays. “Metabolic Heating and the
Prediction of Sex Ratios for Green Turtles (Chelonia mydas).”
Physiological and Biochemical Zoology 74 (2001): 161-170.
Bull, J. J. “Sex Determination in
Reptiles.” The Quaterly Review of Biology 55 (1980): 3-21.
Bull, J. J. “Sex
Ratio and Nest Temperature in Turtles: Comparing Field and Laboratory
Data.” Ecology 66 (1985): 1115-1122.
Bull, J. J., R. C.
Vogt, and C. J. McCoy. “Sex Determining Temperatures in Turtles: A
Geographic Comparison.” Evolution 36 (1982): 326-332.
Ewert, Michael A.,
Ronnie E. Hatcher, and J. Michael Goode. “Sex Determination and
Ontology in Malacocherus tornieri, the Pancake Tortoise.”
Journal of Herpetology 38 (2004): 291-295.
Ezaz, T.,
Valenzuela, N. “An XX/XY sex microchromosome system in a freshwater
turtle, Chelodina longicollis (Testudines: Chelidae) with
genetic sex determination”. Chromosome Research (2006) 14:139-150.
Girondot, Marc,
Helene Fouillet, and Claude Pieau. “Feminizing Turtle Embryos as a
Conservation Tool.” Conservation Biology 12 (1998): 353-362.
Janzen, F. J.
“Climate Change and Temperature-Dependent Sex Determination
inReptiles.” Proceedings of the National Academy of
Sciences of the United States of America 91 (1994): 7487-7490.
Janzen, Frederic J.
“Experimental Evidence for the Evolutionary Significance of
Temperature-Dependent Sex Determination.” Evolution 49 (1995):
864-873.).
Janzen, Frederic J.
“Vegetational Cover Predicts the Sex Ratio of Hatchling Turtles in
Natural Nests.” Ecology 75 (1994): 1593-1599.
Janzen, F. J. and G.
L. Paukstis. “A Preliminary Test of the Adaptive Significance of
Environmental Sex Determination in Reptiles.” Evolution 45
(1991): 435-440.
Janzen, F. J. and G.
L. Paukstis. “Environmental Sex Determination in Reptiles: Ecology,
Evolution, and Experimental Designs.” The Quarterly Review of
Biology 66 (1991): 149-179.
Janzen, F.J. & J.G.
Krenz. “Which was first, TSD or GSD?.” Temperature dependent sex
determination in vertebrates (N. Valenzuela & V.A. Lance,
eds) Smithsonian Institution, 2004.
Kinsell, k.
“Temperature-Dependent Sex determination in Turtles”.
Davidson University, 2003.
Madge, David.
“Temperature and Sex Determination in Reptiles With Reference to
Chelonians.” Testudo 2.3 (1985): 18 pars.
Orenstein, Ronald.
Turtles, Tortoises & Terrapins, Survivors in Armor. Firefly
Books, Canada, 2001.
Pieau, C., M.
Girondot, G. Desvages, M. Dorizzi, N. Richard-Mercier, and P. Zaborski.
“Temperature Variation and Sex Determination in Reptilia".
Experimental Medecine 13 (1995): 516-523.
Ecologie Systematique Evolution.
Shine, R. “Letters
to TREE”. Tree.14-9 (1999) p.360.
Spencer, R.J.,
Thompson, M.B. “The significance of predion in nest site selection of
turtles: an experimental consideration of macro- and microhabitat
preferences”. Oikos 102 (2003): 592-600.
Standora, E. A. and
J.R. Spotila. “Temperature Dependent Sex Determination in Sea Turtles.”
Copeia 3 (1985): 711-722.
“Temperature-Dependent Sex Determination.”
Turtles of the World. 2003. Expert Center for Taxonomic
Identification.
Valenzuela, Nicole,
Dean C. Adams, and Frederic J. Janzen. “Pattern Does Not Equal Process:
Exactly When is Sex Environmentally Determined?” The American
Naturalist 161.4 (2003).
|